La Calciphylaxie en 2024
DOI :
https://doi.org/10.25796/bdd.v8i2.87068Mots-clés :
calciphylaxie, insuffisance rénale, dialyseRésumé
La calciphylaxie est une maladie rare et potentiellement mortelle se manifestant par des ulcérations cutanées progressives dues à la calcification et obstruction des artères de petit calibre et des artérioles. Elle touche principalement les patients atteints de maladie rénale chronique traités par dialyse ou ayant reçu une greffe rénale, mais également des individus avec une fonction rénale normale, souvent associée à des maladies inflammatoires chroniques, néoplasies, hyperparathyroïdie primaire et post-chirurgie bariatrique. Les ulcérations nécrosées peuvent s'infecter et entraîner un syndrome septique, avec une mortalité pouvant atteindre 80 %. Son incidence varie de 1 cas pour 1000 à 1 cas pour 1500 patients hémodialysés par an, bien que cette estimation soit probablement sous-évaluée. Les manifestations cliniques incluent des indurations nodulaires ou en plaques, très douloureuses, survenant aux extrémités, au niveau central du corps. Les lésions peuvent également toucher les doigts, le pénis, les seins et les organes viscéraux tels que les poumons, les intestins et les yeux. Sa prise en charge est complexe et nécessite une approche multimodale et individualisée, impliquant une coopération étroite entre néphrologues, dermatologues, chirurgiens et autres spécialistes. C’est le but de cette revue, de réviser les aspects anciens et nouveaux de cette prise en charge, tout en incluant le contrôle des paramètres des troubles du métabolisme minéral et osseux, le remplacement des antagonistes de la vitamine K par des anticoagulants alternatifs, l’optimisation de la prescription de dialyse et l’utilisation du thiosulfate de sodium, ainsi que des nouvelles thérapies expérimentales en cours de développement. Nous espérons que cette revue aidera à éviter les pièges courants et à fournir des soins de la plus haute qualité aux patients atteints de calciphylaxie.
Introduction
La calciphylaxie est une maladie rare, qui peut potentiellement menacer la vie des patients. Elle se manifeste essentiellement par des ulcérations progressives de la peau résultant de l’obstruction des artères de petit calibre et des artérioles calcifiées. La calciphylaxie touche principalement les sujets avec une maladie rénale chronique (MRC) traités par dialyse ou porteur d’une greffe rénale. Cependant, elle peut exceptionnellement se voir chez des sujets à fonction rénale normale, souvent associée à des maladies inflammatoires chroniques, aux néoplasies, à l’hyperparathyroïdie primaire et après chirurgies bariatrique [1][2][3]. Les manifestations cliniques de la calciphylaxie sont tellement désastreuses, notamment la surinfection des lésions cutanées nécrosées et le syndrome septique associé, qu’elles mènent souvent au décès. Le taux de mortalité peut atteindre jusqu’à 80 % des sujets touchés par la calciphylaxie. Ce phénomène est en partie expliqué par le fait que la plupart de ces patients présentent aussi d’autres comorbidités telles que la dénutrition et des pathologies cardiovasculaires incluant calcifications artérielles, valvulaires, cardiopathies ischémiques, arythmiques et hypertensives et accidents vasculaires cérébraux [4].
Incidence et épidémiologie
La prévalence exacte de la calciphylaxie est encore mal définie, elle varie de 0,03 à 4,0 % dans la littérature et elle est très variable d’un pays à un autre [5][6][7]. Son incidence est estimée chez les patients hémodialysés entre 1 cas pour 1000 et 1 cas pour 1500 patients par an à partir de séries modestes et de petits registres internationaux. Cependant, il est hautement probable que cette incidence soit sous-estimée car certaines lésions cutanées, notamment les lésions mineures et douteuses, sont souvent non diagnostiquées chez une proportion importante des patients. L’étude la plus récente et la plus large sur la calciphylaxie vient d’être réalisée à partir des données de la FMCNA (Fresenius Medical Care North America) collectées entre 2010 et 2014. Elle rapporte 1030 cas de calciphylaxie et une incidence moyenne annuelle de 3,49 cas pour 1000 patients par année (95% IC de 3,30 à 3,72) [7]. L’incidence de la calciphylaxie serait encore plus élevée en Polynésie Française où elle serait d’environ 10 fois plus forte, sans que ces résultats ne soient encore publiés.
Diagnostic
Clinique
Le terme « calciphylaxie » a été employé pour la première fois par Selye en 1961 par contraction de « calcification » et « phylaxie », pour décrire une réaction supposée être adaptative à une agression [8]. En effet, Selye et ses collaborateurs ont réussi à induire des calcifications cutanées en injectant des inducteurs ou des facilitateurs tels que l’hormone parathyroïdienne (PTH) et la vitamine D ou en induisant une hypercalcémie chez le rat ayant subi des traumatismes locaux.
A l’heure actuelle, le terme calciphylaxie est synonyme d’artériolopathie calcifiée urémique (CUA pour calcific uremic arteriolopathy). Il décrit une entité clinique caractérisée initialement par l’apparition d’indurations cutanées nodulaires ou en plaques, très algiques et souvent accompagnées d’une livedo réticulaire. Ces lésions surviennent aux extrémités (Figure 1A) et lorsqu’elles apparaissent en distalité, en dessous des genoux et des coudes, elles peuvent être définies comme périphériques. Elles peuvent aussi s’observer aux territoires plus centraux et plus riches en graisse tels que l’abdomen, le thorax, les fesses, les hanches et les cuisses, pouvant s’étendre en profondeur jusqu’aux muscles squelettiques ( Figure 1B). Elles sont alors décrites comme des lésions centrales. Elles peuvent aussi s’observer aux doigts, touchant plus particulièrement la pulpe des doigts. Plus rarement, des lésions de calciphylaxie peuvent s’observer au niveau du pénis, des seins et des organes viscéraux tels les poumons, les intestins ou les yeux avec thrombose artérielle rétinienne [9][10].
Figure 1A.Lésions périphériques de calciphylaxie
Figure 1B.Lésions centrales de calciphylaxie
Les lésions de calciphylaxie touchant les extrémités inférieures posent le problème du diagnostic différentiel avec quatre maladies : les lésions de vascularite, les ulcérations en rapport avec une artériopathie diabétique, avec les lésions résultant des emboles de cholestérol et les lésions d’angiodermite nécrosante [4][11][12]. Les lésions centrales peuvent poser le problème du diagnostic différentiel avec des lésions de nécrose cutanée induites par les antagonistes de la vitamine K (AVK). 2
Les ulcérations cutanées peuvent survenir et progresser rapidement et s’étendre sur des larges surfaces corporelles, ce qui limitera significativement les capacités de cicatrisation et de guérison. La complication majeure, à éviter autant que possible, est la surinfection des lésions nécrotiques.
Histologie
Les lésions histologiques caractéristiques de la calciphylaxie sont la calcification de la lamina média et la fibrose intimale des artérioles du derme et de l’hypoderme, entrainant un rétrécissement de la lumière. Il est aussi souvent observé des calcifications des terminaisons nerveuses, des adipocytes et des glandes sudoripares [13]. Des thrombi de fibrine peuvent également être observés. Si le traitement de ces lésions n’est pas initié très tôt ou si les lésions résistent malgré le traitement, dans la plupart des cas, l’évolution se fait vers la nécrose des tissus adipeux et cutanés, la surinfection des lésions et les complications septiques générales.
Compte tenu de la rareté de la calciphylaxie, il n’y a pas de procédure clinique ni d’analyse radiologique ou biochimique standardisées menant au diagnostic précis de calciphylaxie. Le caractère très douloureux des lésions et l’association avec la MRC avancée et la dialyse sont des éléments très forts et caractéristiques de la calciphylaxie. Le seul moyen de faire son diagnostic précis est l’analyse histologique d’une lésion. Néanmoins, la biopsie cutanée est encore aujourd’hui un sujet de débat très animé. D’un côté, les opposants à la biopsie cutanée arguent qu’elle provoque un traumatisme local additionnel et crée un nouveau foyer d’ulcération et de nécrose qui peut empirer l’évolution des lésions [14]. De l’autre côté, les partisans de la biopsie cutanée soutiennent que c’est la seule manière de diagnostiquer formellement la calciphylaxie et d’exclure d’autres pathologies telles que les vascularites. Cependant, il faut noter que la sensibilité diagnostique de la biopsie est très variable, allant de 20-80%, que des faux négatifs sont fréquents (47%) et que dans un tiers des cas les prélèvements sont insuffisants [15].
Ce diagnostic passe impérativement par la recherche systématique de calcifications vasculaires grâce aux colorations par le nitrate d’argent (von Kossa ou rouge alizarin). Les calcifications vasculaires peuvent passer inaperçues aux colorations classiques hématoxyline-éosine [13][16]. Une démarche similaire pourrait être également proposée pour les biopsies cutanées chez des sujets suspects de vascularite. L’absence de calcification exclurait formellement la présence d’une potentielle calciphylaxie. La biopsie cutanée devrait être réalisée en marge de la lésion principale ulcérée. En cas de présence de lésions sur une large surface cutanée, une scintigraphie osseuse corps entier triphasée au technétium 99m (99mTc) méthylène diphosphonate (MDP) pourrait s’avérer un bon outil de diagnostic précoce et non invasif de la calciphylaxie avant le développement de lésions nécrotiques et ulcérées. En effet, le traceur radioactif se dépose dans les zones sous-cutanées où un processus de minéralisation est présent [17][18][19][20].
Physiopathologie
Les facteurs de risque
Très peu de données épidémiologiques sont aujourd’hui disponibles concernant la calciphylaxie. Les publications les plus importantes correspondent à des études cas-témoins rétrospectives. Les résultats montrent que les facteurs de risque les plus importants associés au développement de la calciphylaxie sont le genre féminin, la présence d’un diabète, le traitement par la dialyse péritonéale, l’obésité, l’hypoalbuminémie, les états inflammatoires et d’hypercoagulabilité, les maladies auto-immunes, l’utilisation des AVK, le traitement par du fer intraveineux et l’augmentation du produit phosphocalcique en combinaison avec l’utilisation de dérivés actifs de la vitamine D et/ou de doses excessives de chélateurs du phosphate à base de calcium [4][21][22]. Dans l’étude la plus récente et la plus large sur la calciphylaxie, celle de la FMCNA, il a été observé que les injections répétées d’insuline chez les sujets diabétiques, avec les lésions traumatiques récurrentes de la peau qu’elles peuvent provoquer, augmentent jusqu’à 4 fois le risque de calciphylaxie (odds ratio 3,74 ; 95% IC de 2,28 à 6,25) [13][23][24].
Des prédispositions génétiques pourraient aussi contribuer à la susceptibilité de développer une calciphylaxie, comme le suggère une étude récente montrant une incidence inhabituellement élevée de la calciphylaxie chez les patients māoris dialysés en Australie et en Nouvelle-Zélande [25]. Des polymorphismes dans plusieurs gènes impliqués dans le métabolisme vasculaire, minéral et osseux, tels que le gène NT5E codant pour la protéine CD73, le gène du récepteur de la vitamine D et celui du FGF23, ont été associés à un risque accru de calciphylaxie [26][27]. Compte tenu de ces influences génétiques et géographiques, l’obtention d’un historique régionale détaillée et des antécédents familiaux peut fournir des informations diagnostiques précieuses lors de l’évaluation de cas suspects de calciphylaxie.
Dans la plupart des cas cliniques reportés, les épisodes de calciphylaxie sont toujours associés à des altérations du métabolisme phosphocalcique. Il s’agit notamment d’une augmentation du produit phosphocalcique, souvent dans un contexte d’hyperparathyroïdie secondaire (HPTS) ou tertiaire. Il est ainsi démontré, dans une série de cas cliniques de l’Université du Wisconsin, que la réalisation d’une parathyroïdectomie (PTX) en urgence pouvait améliorer de façon spectaculaire certaines lésions de la calciphylaxie [28]. Dans l’étude de la FMCNA, dont les données étaient recueillies à l’initiation du traitement par la dialyse, la valeur médiane de la PTH était significativement plus élevée dans le groupe développant la calciphylaxie comparé au groupe témoin, même si la PTH restait dans les valeurs recommandées par les KDIGO, c’est à dire, entre 2 et 9 fois la limite supérieure de la normale [24]. Cependant, il est à noter que dans d’autres séries étudiées, l’inverse était observé avec l’installation d’une calciphylaxie sévère de novo chez des patients ayant subi une PTX. Des données préliminaires du registre Allemand de la calciphylaxie montre également l’existence d’une valeur de PTH basse chez deux tiers des patients avec calciphylaxie [29][30]. Les deux formes d’atteintes osseuses, aussi bien celle caractérisée par un haut remodelage osseux comme dans les cas d’une HPTS, que celle caractérisée par un bas remodelage osseux comme dans le cas de l’ostéopathie adynamique (ABD), provoquent des altérations du métabolisme minéral qui prédisposent ou favorisent la survenue de la calciphylaxie. Dans les deux situations, haut (HPTS) et bas (ABD) remodelages osseux, il existe une tendance à l’augmentation du produit phosphocalcique et du risque de calciphylaxie [29][30]. C’est l’incapacité de l’os à tamponner l’excès de calcium («calcium buffer») qui crée un environnement favorable à la minéralisation des tissus mous extra-squelettiques. Finalement, il est à noter qu’il existe une étroite corrélation entre l’utilisation des AVK (warfarine) et la survenue de la calciphylaxie. Les éventuels mécanismes physiopathologiques impliqués dans la calciphylaxie en cas de traitement par des AVK sont discutés ci-dessous [23][24].
Les inhibiteurs de la minéralisation ectopique
Plusieurs observations faites ces derniers temps suggèrent l’existence d’un dérèglement local et/ou systémique, non souhaité, dans la balance des facteurs promoteurs/inhibiteurs du processus de minéralisation extra-squelettique. En l’occurrence, deux molécules prototypes des inhibiteurs de la calcification sont impliquées fortement dans la calciphylaxie, la MGP (Matrix Gla Protein) [24]et la fétuine A (alpha2-Heremans Schmid glycoprotein ou AHSH) [29].
La MGP est une protéine de 10 kD exprimée exclusivement dans les cellules musculaires lisses de la paroi vasculaire (VSMC) et dans les chondrocytes. Pour être complètement active, la MGP doit subir une gamma-carboxylation post-traductionnelle, laquelle est dépendante de la vitamine K. Les antagonistes de la vitamine K comme la warfarine inactivent la MGP et peuvent favoriser le processus de calcification vasculaire [31]. Les souris invalidées du gène MGP (MGP-/-) présentent une calcification sévère de la lamina média des artères de gros calibre et de l’aorte. Elles meurent vers l’âge de 6 à 8 semaines d’hémorragie interne secondaire à la rupture de l’aorte complètement ossifiée [32]. L’effet protecteur de la MGP contre les calcifications vasculaires semble être local (autocrine/paracrine) car sa surexpression systémique ne permet pas de prévenir ou de faire régresser les calcifications vasculaires du model MGP-/-. Similairement, des calcifications de la tunica média artérielle peuvent être induites par les antagonistes de la vitamine K. Chez le rat, les calcifications vasculaires induites par les antagonistes de la vitamine K peuvent partiellement régresser par l’administration de doses supra-physiologiques de vitamine K1 ou K2 ou par la suspension du blocage de la vitamine K [33][34][35]. L’administration de doses faibles de vitamine K1 ou K2 est incapable d’empêcher la progression des calcifications vasculaires [36].
La deuxième molécule importante dans l’inhibition de la calcification vasculaire et dans la physiopathologie de la calciphylaxie est la fétuine A. La fétuine A est une glycoprotéine de 60 kD produite par le foie [37]. Elle est peut-être l’inhibiteur circulant le plus puissant de la calcification vasculaire. Sa concentration plasmatique peut atteindre 0,5 à 1,0 g/litre chez les sujets normaux, représentant une fraction importante de la bande alpha-2 dans l’électrophorèse des protides sanguins [38]. La fétuine A est une protéine négativement régulée par la phase réactive aiguë de l’inflammation (« negative acute phase reactant »). Lors d’un processus inflammatoire les concentrations systémiques et locales de fétuine A baissent dramatiquement exposant ainsi le patient à la formation de calcifications vasculaires [37][39]. Il est à noter que les rares cas de calciphylaxie observés chez des sujets avec une fonction rénale normale étaient toujours associés à des maladies inflammatoires chroniques actives ou à de la dénutrition, comme celle observée après une chirurgie bariatrique [40][41]. Les animaux invalidés pour la fétuine A (fétuine A-/-) développent spontanément une calcification massive des tissus mous et des organes internes [37]. Un grand nombre de patients MRC traités par dialyse présentent une concentration sérique de fétuine A en dessous de la valeur normale de référence. Cette déficience en fétuine A est associée à une augmentation du risque relatif de mortalité toutes causes et de mortalité cardiovasculaire [42][43][44][45]. Chez huit patients bien caractérisés, inclus dans le registre Allemand de la calciphylaxie, il a été trouvé une concentration circulante de fétuine A extrêmement basse (allant de 0,09 à 0,25 g/litre), avec en parallèle une concentration sérique élevée de protéine C réactive (CRP) [29].
Le rôle de la cellule endothéliale
L’étude de Ellis et coll. publiée en 2018 remet en cause la spécificité des calcifications dans la calciphylaxie [11]. En effet, les auteurs ont observé, chez des patients dialysés asymptomatiques, les même calcifications vasculaires et extravasculaires que celles décrites dans la calciphylaxie, avec la même prévalence et les mêmes localisations. Ils ont cependant observé une prévalence des thromboses artériolaires bien plus élevée chez les patients atteints de calciphylaxie que chez les patients asymptomatiques. Ces données suggèrent que les calcifications intimales artériolaire du derme et de l’hypoderme ne sont pas suffisantes pour induire les lésions de calciphylaxie et qu’une agression endothéliale supplémentaire serait nécessaire pour conduire aux thromboses artériolaires et aux lésions.
Une étude a récemment montré que plus de 80% des patients atteints de calciphylaxie présentent une activation microvasculaire du complément démontrée par la présence de dépôt endothéliaux de C5b-9 au niveau des vaisseaux lésés [46]. Dans 40% des cas, les patients présentaient également des dépôts microvasculaires de C5b-9 au niveau du derme, témoignant d’une activation systémique du complément. Ces études tendent à rapprocher la calciphylaxie du spectre des microangiopathies thrombotiques, tel que le syndrome hémolytique et urémique atypique ou le syndrome des anti-phospholipides et pourraient ouvrir la voie vers les thérapies ciblant le complément dans la calciphylaxie [47][48].
Traitements
Mesures générales
Les approches thérapeutiques sont encore très limitées en cas de calciphylaxie comme signalé auparavant. Les données disponibles ne concernent que quelques cas cliniques isolés ou de petites séries de cas rétrospectives. Les deux méta-analyses récemment publiées, incluant toutes les études cliniques prospectives, dont 5 essais cliniques randomisés, ont évalué les différentes stratégies thérapeutiques dans la calciphylaxie, dont la parathyroïdectomie, le cinacalcet, les bisphosphonates, l’oxygénation hyperbare et le thiosulfate de sodium. Elles n’ont pas réussi à démontrer de bénéfice clinique évident de ces cinq approches thérapeutiques [49][50].
Lorsque le diagnostic de calciphylaxie est confirmé chez un patient urémique, une des premières mesures à prendre est la mise en place d’une prise en charge multidisciplinaire impliquant les néphrologues, les dermatologues, les diététiciennes ou nutritionnistes, les chirurgiens vasculaires/plasticiens, les assistants sociaux et les équipes de soins anti-douleur et palliatifs [51]. L’implication précoce de l’équipe de soins des plaies est essentielle pour la sélection des pansements les plus appropriés, l’utilisation d’agents de débridement chimique et l’application d’une thérapie par pression négative des plaies si nécessaire. Le débridement chirurgical par un spécialiste est fortement conseillé pour les plaies visiblement infectées ou nécrotiques sans signes de tissu de granulation. Le débridement de la plaie doit être associé à une thérapie par pression négative, suivi d’une greffe de peau dans la mesure du possible [52]. Une antibiothérapie à large spectre devrait être également proposée dès que les lésions ulcéreuses deviennent progressives et nécrotiques. Le soutien nutritionnel est essentiel pour lutter contre la dénutrition protéino-énergétique et augmenter la cicatrisation des plaies. L’albuminémie devrait être normalisée dans la mesure du possible car elle joue un rôle important dans l’inhibition de la minéralisation extra-osseuse [2]. Le soulagement de la douleur est capital et nécessite la prescription des analgésiques possédant différents mécanismes d’action, tout en ayant comme objectif de réduire au maximum la consommation d’opioïdes [53]. Il ne faut pas exclure d’avoir recours à des anesthésies régionales, tel que le blocage sympathique au niveau lombaire, pour des douleurs réfractaires [54]. Dans une proportion importante des patients atteints de calciphylaxie, il sera nécessaire d’impliquer précocement l’équipe des soins palliatifs, non seulement pour la gestion des symptômes comme la douleur, le prurit, la perte de l’appétit et les troubles du sommeil, mais aussi pour améliorer la qualité des soins de fin de vie.
L’oxygénation à haute pression
Les patients souffrant de calciphylaxie pourraient également bénéficier d’un traitement des lésions par oxygénothérapie à haute pression (caisson hyperbare). Basile et coll. ont récemment rapporté d’excellents résultats obtenus par cette thérapie dans une petite série de patients urémiques [55]. Le but de cette approche est d’augmenter de façon significative la pression locale en oxygène et d’essayer d’améliorer la cicatrisation des tissus ulcérés et nécrosés. Dans leur étude, les zones affectées étaient exposées à 100 % d’oxygène, sous une pression de 2,5 fois la pression atmosphérique, dans une chambre fermée et pendant une durée de 90 minutes à chaque session. Le nombre de sessions nécessaires allait de 20 à 108. Huit des 11 patients ont montré une guérison complète des lésions ulcérées de calciphylaxie. Cependant, l’utilisation de l’oxygénothérapie hyperbare est limitée en raison de son coût élevé, de l’accès restreint aux chambres hyperbares, des défis logistiques liés au transport, des contre-indications cardiaques, neurologiques ou pulmonaires et de l’inconfort potentiel, par exemple, en cas de claustrophobie.
Optimisation du traitement par dialyse
L’optimisation du traitement par dialyse telle que recommandée par la NKF-KDOQI (National Kidney Foundation-Kidney Disease Outcomes Quality Initiative) en 2015 est primordial [56]. Le premier objectif de cet approche thérapeutique est d’essayer de normaliser la concentration circulante du produit phosphocalcique, par exemple en augmentant la durée et la fréquence des séances de dialyse, la surface de la membrane de dialyse et ou le volume de convection. Quelques cas rapportés ont montré une guérison complète des lésions ulcéreuses de calciphylaxie après le passage d’une hémodialyse standard vers une hémodialyse courte quotidienne à domicile (6 séances de 2h30 à 3h00 par semaine) [57][58]. Il n’y a pas d’indication formelle au remplacement de la dialyse péritonéale par une autre technique plus performante, sauf si les performances de la dialyse péritonéale ne sont pas adéquates. Il n’y a pas non plus d’arguments scientifiques solides pour transférer les patients atteints de calciphylaxie vers l’hémodiafiltration en ligne, d’autant que cette méthode pourrait s’accompagner d’une perte plus importante d’albumine et d’autres protéines inhibitrices de la calcification extra-osseuse telle que la MGP.
Correction des désordres du métabolisme minéral et osseux
Le contrôle du produit phosphocalcique peut aussi nécessiter l’utilisation d’un bain de dialyse appauvri en calcium (< 1,25 mmol/litre) ; la prescription de chélateurs du phosphate, de préférence non calciques. Il est nécessaire de réduire, voire d’arrêter, le traitement par les dérivés naturels et actifs de la vitamine D, ou d’adapter leur posologie en fonction de la valeur de PTH et du produit phosphocalcique. L’objectif ultime est de normaliser la phosphatémie tout en évitant l’hypercalcémie [59]. La transplantation rénale en urgence pourrait être une stratégie à discuter, à condition que le patient ne présente pas de contre-indication. Ainsi, trois cas de guérison de la calciphylaxie ont été rapportés 2 à 4 mois après la greffe rénale [60].
Lorsqu’un patient présente une calciphylaxie et une HPTS sévère avec des signes cliniques, biologiques et radiologiques de haut remodelage osseux, il est licite de considérer l’indication d’une parathyroïdectomie chirurgicale (PTX) en urgence afin de ramener la PTH dans les valeurs recommandées par les KDIGO [59]. Six patients avec calciphylaxie et ayant subi une PTX subtotale (3,5 glandes) ont tous présenté une résolution de la douleur et une cicatrisation des lésions cutanées, alors que les lésions persistaient chez 7 patients n’ayant bénéficié que de la seule prise en charge médicale. De plus, les 6 patients parathyroïdectomisés sont restés en vie alors que 5 patients sur 7 non parathyroïdectomisés sont décédés des suites de complications liées à la calciphylaxie [28][49]. Néanmoins, chez certains de ces patients, surtout lorsqu’il y a une contre-indication chirurgicale, la prescription d’un calcimimétique oral ou injectable peut représenter une autre alternative thérapeutique [61][62]. La dose de ce calcimimétique doit être titrée pour maintenir la PTH dans l’intervalle recommandé par les KDIGO (2 à 9 fois la limite supérieure de la normale (LSN)). Une suppression excessive de la PTH (< 2 LSN ou < 130 pg/mL) doit être évité car cela augmente le risque de maladie osseuse adynamique prédisposant les patients à la calcification vasculaire et à la calciphylaxie [63]. Une méta-analyse récente à partir des études observationnelles a montré que l’utilisation du cinacalcet ne diminuait pas le risque de détérioration des plaies de calciphylaxie, d’amputation ni de mortalité [49]. Cependant, l’étude EVOLVE (Evaluation of Cinacalcet Therapy to Lower Cardiovascular Events), évaluant l’effet du cinacalcet sur la survenue des évènement cardiovasculaires majeurs et le décès, n’a pas montré de bénéfice par rapport au placebo, mais que parmi les 3 861 patients participant à l’essai et ayant reçu au moins une dose de cinacalcet, seulement 6 patients ont développé une calciphylaxie dans ce groupe alors qu’il y en avait 18 dans le groupe assigné au placebo. Le risque relatif non ajusté de développer une calciphylaxie était diminué de 69% [64].
D’autres stratégies peuvent être envisagées afin de diminuer le taux de remodelage osseux, notamment avec l’utilisation de bisphosphonates et du denosumab. Pour les bisphosphonates, lesquels sont analogues du pyrophosphate, il reste encore à démontrer si leur potentiel effet bénéfique sur la prévention de la minéralisation extra-squelettique s’exerce par ses effets anti-résorption osseuse ou par un effet directement local comme l’effet des pyrophosphates. Dans une étude observationnelle prospective incluant 11 patients dialysés, le traitement par pamidronate, pendant 2 à 4 semaines, a retardé la progression des lésions et amélioré la survie, comparés à 12 autres patients suivant une approche thérapeutique conventionnelle : débridement de lésions et dialysat pauvre en calcium [65][66]. Or, compte-tenu du risque important d’induire une pathologie osseuse à bas remodelage avec leur utilisation, il est hautement conseillé de s’assurer que le patient n’a pas de bas remodelage osseux avant l’initiation d’un traitement par bisphosphonates, spécialement chez les patients avec une MRC. Pour le denosumab, il n’existe pas encore de données publiées. Des résultats très prometteurs ont été récemment publiés concernant ce type de prise en charge conservatrice de la calciphylaxie [67][68].
Le thiosulfate de sodium
Le thiosulfate de sodium est normalement utilisé comme un agent chélateur en cas d’intoxication par le cyanure. Il possède une très haute affinité pour le calcium, et de ce fait, en se liant au calcium, il forme un composé thiosulfate de calcium beaucoup plus soluble que le composé phosphate de calcium, pouvant être potentiellement éliminé par la dialyse. Le thiosulfate de sodium possède aussi des propriétés antioxydantes et pourrait par cette voie interférer et limiter le processus inflammatoire local en cas de calciphylaxie. La perfusion intraveineuse de thiosulfate de sodium réduit les dépôts calciques dans les adipocytes et les cellules musculaires lisses artérielles chez des patients atteints de calciphylaxie [69][70]. Le thiosulfate de sodium est utilisé généralement par voie intraveineuse. Chez le patient dialysé il est recommandé de débuter à une dose de 12,5 mg par dialyse, usuellement 3 fois par semaine, cette dose sera augmentée progressivement jusqu’à 25 mg par dialyse selon la tolérance du patient. Son administration doit se faire par perfusion intraveineuse lente pendant les dernières 30 à 120 minutes de la dialyse. Il est aussi conseillé de diminuer la concentration de sodium du dialysat afin d’atténuer la charge sodique apportée par le thiosulfate de sodium [71]. Une étude observationnelle incluant 27 patients dialysés atteints de calciphylaxie a montré la rémission complète des lésions chez 52% des patients et une régression partielle dans 19% des cas [72]. Une autre étude chez 53 patients dialysés avec calciphylaxie a observé une guérison complète des lésions dans 26% des cas et une amélioration chez 19% des patients [73].
Chez les patients traités par dialyse péritonéale, le thiosulfate de sodium peut être mis dans le liquide de dialyse péritonéale (25 g) et laissé stagner pendant le temps d’échange le plus long [74]. Deux autres formes d’administrations du thiosulfate de sodium ont été essayées, l’une par voie orale, l’autre par injection intra-lésionnelle. Dans les études évaluant le thiosulfate de sodium oral, à une dose allant de 1,2 à 2,6 grammes par jour, les résultats obtenus sont contestés, 2 patients parmi 4 inclus ont amélioré leurs lésions, mais les diarrhées et effets indésirables digestifs étaient fréquents [75]. Pour la voie intra-lésionnelle, des essais ont été faits en injectant 1 à 3 mL de thiosulfate de sodium (250 à 750 mg) une fois par semaine avec également des résultats à confirmer par des études plus larges [76].
La durée optimale du traitement par le thiosulfate de sodium n’a pas été étudiée dans des études contrôlées. Elle est le plus souvent adaptée à la tolérance du patient et à l’évolution des lésions. Les effets indésirables comprennent des troubles gastro-intestinaux tels que les nausées et les vomissements, la surcharge volémique, l’hypocalcémie, un allongement de l’intervalle QT, les hypotensions artérielles, l’acidose métabolique avec augmentation de du trou anionique et la péritonite en cas d’administration par voie intrapéritonéale.
Au total, l’efficacité du thiosulfate de sodium a été rapportée dans de nombreuses publications de cas uniques ou de petites séries de cas de calciphylaxie. Cependant, l’efficacité et les bénéfices du traitement de la calciphylaxie par le thiosulfate de sodium restent encore à être prouvées scientifiquement chez les patients urémiques, comme le suggère une récente méta-analyse incluant 147 études dont quelques petites études randomisées et 860 patients dialysés atteints de calciphylaxie. Comparé à l’approche thérapeutique standard, le thiosulfate de sodium n’a amélioré ni la survie, ni la cicatrisation des lésions, ni le risque d’amputation [49].
La vitamine K
En dépit de l’absence de preuve scientifique, chez les patients présentant une calciphylaxie et traités par AVK, il est vivement recommandé de les remplacer par de l’héparine ou par une autre thérapie anticoagulante de dernière génération. Concernant la supplémentation en vitamine K, certains cas de guérison complète des plaies et la fermeture des ulcères ont été rapportés après traitement par de la vitamine K1 (phylloquinone) [77]. Des résultats préliminaires de l’essai VitK-CUA suggèrent que la vitamine K1 pourrait aider à soulager la douleur et à réduire la surface totale des lésions dans la calciphylaxie, même en l’absence de cinacalcet ou d’utilisation intralésionnelle de thiosulfate de sodium [78](Nigwekar et al Kidney Week 2023; November 2-5, Philadelphia, Pennsylvania. Poster TH-PO1156). Compte tenu qu’il existe une très grande probabilité biologique que le traitement par des AVK puisse favoriser la survenue de la calciphylaxie, il sera d’une extrême importance d’investiguer, par de futures études randomisées, si la supplémentation en vitamine K peut prévenir ou faire régresser les lésions de calciphylaxie chez les patients urémiques.
La rhéophérèse
La rhéophérèse est une plasmaphérèse par double filtration destinée à améliorer la rhéologie sanguine des micro-vaisseaux [79][80][81]. Lors d’un traitement par rhéophérèse, le plasma est séparé du sang par un premier filtre puis soumis à un second filtre avant restitution. Ainsi, les molécules d’intérêt sont retenues par le second filtre avant que le plasma ne soit restitué au patient. La taille des pores des deux filtres détermine la nature des protéines retirées du plasma avant restitution. On peut ainsi sélectionner des filtres primaires et des filtres secondaires ayant des pores d’une taille proche de 300 nm et 25 nm, respectivement. La rhéophérèse avec ces deux filtres permet alors de purifier les protéines de haut poids moléculaire entre 25 et 300 nm, impliquées dans la viscosité du plasma, telles que l’alpha-2- macroglobuline, le fibrinogène ou le cholestérol LDL. Elle peut également purifier les calciprotéines secondaire dont la taille est estimée entre 120 et 150 nm. Les séances itératives de rhéophérèse entraînent une diminution de la concentration plasmatique de ces molécules avec une diminution de la viscosité plasmatique et une amélioration de la microcirculation (effet Fahraeus Lindqvist) [80]. Ainsi la rhéophérèse pourrait améliorer la microcirculation des territoires ischémiques secondaire à la calciphylaxie. Il existe d’autres intérêts théoriques à l’utilisation de la rheophérèse dans la calciphylaxie : 1/ la purification des calciprotéines secondaires avec un bénéfice sur l’inflammation et la calcification vasculaire, 2/ l’augmentation de la production de NO et de bradykinine et 3/ la réduction de l’expression des molécules d’adhésion, telles que ICAM-1 et VCAM-1 [81][82]. Cette technique est également séduisante par sa facilité d’accès pour les néphrologues. Il est possible de réaliser la rhéophérèse en même temps que la dialyse, ce qui permet d’incrémenter la thérapeutique sans majorer le temps de soins du patient. L’innocuité et l’efficacité de la rhéophérèse ont été démontrées dans d’autres maladies microcirculatoires telles que la dégénérescence maculaire liée à l’âge (DMLA) et l’artérite des membres inférieurs [79]. A ce jour peu de données sont disponibles sur l’utilisation de la rhéophérèse comme traitement adjuvant de la calciphylaxie. Des résultats prometteurs ont été rapportés chez deux patients présentant des lésions nécrotiques péjoratives [83][84]et dans une série de cas où 5 des 8 patients atteints de calciphylaxie ont eu une guérison complète après avoir été traités par rhéophérèse [85][91]. L’intérêt pour cette technique est croissant et le nombre de centres de néphrologie en France qui la pratiquent est en augmentation. Cependant le niveau de preuve du bénéfice de la rhéophérèse dans la calciphylaxie n’est pas encore scientifiquement établi. Une étude nationale française rétrospective (RHEO-CUA) des cas de calciphylaxie traités par rhéophérèse est en cours, ainsi qu’un essai prospectif contrôlé et randomisé, pour évaluer l’efficacité de la rhéophérèse en traitement adjuvant dans la calciphylaxie nécrosante du patient hémodialysé (PHRC-N ; RHEO-CAL ; NCT04654000).
SNF472
Le SNF472 est le nom d’étude de la molécule phytate d’héxasodium, autrement dit un sel d’héxasodium de myo-inositol héxaphosphate. Le SNF472 est un inhibiteur de la calcification vasculaire. Les études précliniques, avec des cellules en culture in vitro, ont démontré la capacité du SNF472 à se lier à l’hydroxyapatite et à prévenir la formation et la croissance des cristaux d’hydroxyapatite. Les essais cliniques de phase 1 et 2 ont montré la sécurité et l’efficacité potentielle du SNF472 pour atténuer la cristallisation de l’hydroxyapatite chez les patients en hémodialyse [77][86]. De plus, il a été démontré que le SNF472 est capable d’atténuer significativement la progression de la calcification des artères coronaires et de la calcification de la valve aortique chez les patients dialysés [87][88].
Dans la calciphylaxie, un essai clinique récent de phase 3, en ouvert, randomisé, contrôlé et en double aveugle (CALCIPHYX) mené chez 71 patients hémodialysés (37 patients assignés au SNF472 et 34 patients assignés au placebo) n’a pas atteint les critères d’efficacité principaux de modification en 8 points de l’outil d’évaluation des plaies de Bates-Jensen et de la douleur sur une échelle visuelle analogique. Cependant, une analyse post-hoc a révélé des taux d’hospitalisation et de mortalité plus faibles dans le groupe SNF472 par rapport au placebo [89]. Le SNF472 est administré actuellement, comme le thiosulfate de sodium, par voie intraveineuse lente pendant la dialyse (2 à 3 heures), trois fois par semaine. Néanmoins, des données préliminaires sur des modèles animaux indiquent que le SNF472 sous-cutané pourrait atteindre des concentrations thérapeutiques [86], soutenant ainsi des recherches supplémentaires sur des stratégies d’administration alternatives. De futures études sont nécessaires pour évaluer la faisabilité des formulations sous-cutanées ou intrapéritonéales, ce qui pourrait potentiellement étendre l’accessibilité du SNF472 aux patients sous dialyse péritonéale et non dialysés.
INZ-701
Le pyrophosphate inorganique (PPi) est un puissant inhibiteur de la calcification vasculaire ectopique et un faible taux de PPi est associé à la calciphylaxie et à une moins bonne survie [90]. L’ectonucléotide pyrophosphatase/phosphodiestérase 1 (ENPP1) est une enzyme responsable de la génération de PPi et des stratégies visant à augmenter l’activité de l’ENPP1 pourraient aider à restaurer les niveaux de PPi et à réduire la calcification vasculaire ainsi que la calciphylaxie. INZ-701 est une protéine de fusion contenant l’enzyme fonctionnelle ENPP1 et fait actuellement l’objet d’une investigation clinique pour évaluer sa sécurité, sa pharmacocinétique et sa pharmacodynamie chez les patients sous hémodialyse. En augmentant les niveaux de PPi, INZ-701 promet d’être une thérapie potentielle pour prévenir ou traiter la calciphylaxie.
Autres approches thérapeutiques
Finalement, d’autres approches thérapeutiques ont été envisagés, mais restent à être validés par des études contrôlées. Par exemple, concernant les corticostéroïdes, Fine et Zacharias ont rapporté la guérison complète de 36 cas de calciphylaxie débutante, caractérisée par des lésions non ulcérées [91]. Ces résultats sont à considérer avec beaucoup de précaution compte tenu du haut risque de surinfection dans la calciphylaxie. On peut également citer parmi les approches testées dans la calciphylaxie : les antagonistes de l’endothéline, dont le bosentan [92], les agents thrombolytiques comme l’activateur tissulaire du plasminogène [93], le nitrate de cérium en application topique [94], la greffe de membrane amniotique humaine cryopréservée [95], les échanges plasmatiques [96], la cryofiltration plus aphérèse [97], l’utilisation de larve (Lucilia sericata) pour la détersion des plaies en association à la pentoxyphyline [98].
Conclusion
La calciphylaxie est une maladie rare, avec des complications désastreuses au cours de la maladie rénale chronique, associée à un risque extrêmement élevé de mortalité. Son incidence est probablement sous-estimée. Les progrès scientifiques récents mettent en exergue le rôle important d’un déficit en facteurs inhibiteurs de la calcification (MGP et fétuine A) dans la physiopathologie de la calciphylaxie. Généralement, l’objectif de la prise en charge est la diminution de la concentration sérique du produit phosphocalcique. La réalisation d’une parathyroïdectomie ou les calcémimétiques, lorsqu’il existe une hyperparathyroïdie secondaire importante et cliniquement incontrôlable restent des options thérapeutiques. Les AVK doivent être interrompus et remplacés par une héparine ou une autre thérapie anticoagulante lorsque c’est possible. Dans le futur, les nouvelles stratégies thérapeutiques telles que la supplémentation en vitamine K, les calcimimétiques, les bisphosphonates, les anticorps anti RANK-L (Denosumab), le thiosulfate de sodium, la réophérèse, le SNF472 et l’INZ-701 pourraient trouver une réelle indication dans notre pratique clinique quotidienne. Cependant, dans l’état actuel des connaissances, l’indication à ces traitements doit être considérée avec précaution et au cas par cas.
Les points à retenir
Critères diagnostiques :
- Le terrain : Dialysé, obèse, sexe féminin, diabétique, traité par antivitamine K (AVK), vasculaire, dénutrition, produit phosphocalcique (Ca x P) élevé, hyperparathyroïdie secondaire sévère
- Les circonstances : Choc, déshydratation, sepsis, traumatisme, injections sous cutanées
- Les lésions : Livedo, nodosités douloureuses, ulcérations nécrotiques
- Biopsie cutanée : utile en cas de doute diagnostique
- Examens paracliniques : Tomodensitométrie (TDM) rayons mous, échographie (mammaire), scintigraphie osseuse, radiographie simple, à la recherche de calcifications des petits vaisseaux
Prise en charge thérapeutique :
- Amélioration de l’oxygénation et de la perfusion tissulaire :
o Thiosulfate de sodium (STS) (intraveineux ou localement)
o Caisson hyperbare
o Rhéophérèse
o Traitement des lésions artérielles d’amont
o Dialyse quotidienne pour lutter contre les hypotensions, les variations volumiques, l’hyperphosphatémie, et permettant une nutrition parentérale
- Atténuer la progression des calcifications microvasculaires :
o Thiosulfate de sodium (STS)
o Arrêt définitif des AVK (relai héparine ou des nouveaux anticoagulants oraux tel l’apixaban ou le rivaroxaban) ; supplémentation en vitamine K
o Dialysat pauvre en calcium (1.25 mmol/litre)
o Arrêt des dérivés vitaminiques D et des apport calciques
o Contrôle de l’hyperparathyroïdie secondaire (calcimimétiques, parathyroïdectomie)
o Bisphosphonates selon les cas
- Traitement de la douleur :
o Thiosulfate de sodium
o Dérivés morphiniques
o Protoxyde d’azote pour les pansements
- Traitement des plaies
o Pansements, détersion
o Antibiothérapie
o Débridement chirurgical
o Greffe de peau
- Lutte contre la dénutrition et la grabatisation
o Alimentation entérale/parentale
o Kinésithérapie, nursing
o Soutien psychologique
Contributions des auteurs
Pablo Urena a conçu le projet et rédigé le texte, Denis Viglietti et Ziad Massy ont relu le texte et fait part de leurs remarques constructives.
Considérations éthiques
N/A
Consentement du patient
N/A
Financement
Aucun
Conflits d’intérêt
Les auteurs déclarent n’avoir aucun conflit d’intérêt avec cette publication
Numero ORCID :
Pablo Urena : https://orcid.org/0000-0001-6757-1906
Denis Viglietti : https://orcid.org/0000-0003-3025-1479
Ziad Massy : https://orcid.org/0000-0001-5771-5996
Références
- Cucka B., Biglione B., Ko L., Nguyen E.D., Khoury C.C., Nigwekar S.U.. Calciphylaxis arising following bariatric surgery: A case series. JAAD Case Rep. 2022; 28:4-7.
- Nigwekar S.U., Kroshinsky D., Nazarian R.M., Goverman J., Malhotra R., Jackson V.A.. Calciphylaxis: risk factors, diagnosis, and treatment. Am J Kidney Dis. 2015; 66(1):133-46.
- Xia J., Tan A.J., Biglione B., Cucka B., Ko L., Nguyen E.D.. Nephrogenic Calciphylaxis Arising after Bariatric Surgery: A Case Series. Am J Nephrol. 2024; 55(2):196-201.
- Nigwekar S.U., Thadhani R., Brandenburg V.M.. Calciphylaxis. N Engl J Med. 2018; 379(4):399-400.
- Angelis M., Wong L.L., Myers S.A., Wong L.M.. Calciphylaxis in patients on hemodialysis: a prevalence study. Surgery. 1997; 122(6):9-90.
- Gabel C.K., Nguyen E.D., Chakrala T., Blum A.E., Francois J., Chand S.. Assessment of outcomes of calciphylaxis. J Am Acad Dermatol. 2021; 85(4):1057-64.
- Nigwekar S.U., Zhao S., Wenger J., Hymes J.L., Maddux F.W., Thadhani R.I.. A Nationally Representative Study of Calcific Uremic Arteriolopathy Risk Factors. J Am Soc Nephrol. 2016; 27(11):3421-9.
- Selye H., Gentile G., Prioreschi P.. Cutaneous molt induced by calciphylaxis in the rat. Science. 1961; 134(3493):1876-7.
- Ghosh T., Winchester D.S., Davis M.D.P., El-Azhary R., Comfere N.I.. Early clinical presentations and progression of calciphylaxis. Int J Dermatol. 2017; 56(8):856-61.
- Naranjo A., Rayess N., Ryan E., Iv M., Mahajan V.B.. Retinal artery and vein occlusion in calciphylaxis. Am J Ophthalmol Case Rep. 2022; 26(101433)
- Ellis C.L., O'Neill W.C.. Questionable specificity of histologic findings in calcific uremic arteriolopathy. Kidney Int. 2018; 94(2):390-5.
- Jeong H.S., Dominguez A.R.. Calciphylaxis: Controversies in Pathogenesis, Diagnosis and Treatment. Am J Med Sci. 2016; 351(2):217-27.
- Rivet J., Lebbe C., Urena P., Cordoliani F., Martinez F., Baglin A.C.. Cutaneous calcification in patients with end-stage renal disease: a regulated process associated with in situ osteopontin expression. Arch Dermatol. 2006; 142(7):900-6.
- Dobry A.S., Nguyen E.D., Shah R., Mihm M.C., Kroshinsky D.. The role of skin biopsy in diagnosis and management of calciphylaxis: A retrospective analysis. J Am Acad Dermatol. 2021; 85(3):765-7.
- Williams E.A., Moy A.P., Cipriani N.A., Nigwekar S.U., Nazarian R.M.. Factors associated with false-negative pathologic diagnosis of calciphylaxis. J Cutan Pathol. 2019; 46(1):16-25.
- Mochel M.C., Arakaki R.Y., Wang G., Kroshinsky D., Hoang M.P.. Cutaneous calciphylaxis: a retrospective histopathologic evaluation. Am J Dermatopathol. 2013; 35(5):582-6.
- Groover M., Nutan F.. Role of bone scan in diagnosis of calciphylaxis: A review. JAAD Int. 2024; 14:31-3.
- Gupta K., Suthar P.P., Bhave N., Singh J.S., Venkatraman S.M.K., Jadhav R.B.. Potential Role of Bone Scintigraphy in the Diagnosis of Calciphylaxis. World J Nucl Med. 2024; 23(1):3-9.
- Paul S., Rabito C.A., Vedak P., Nigwekar S.U., Kroshinsky D.. The Role of Bone Scintigraphy in the Diagnosis of Calciphylaxis. JAMA Dermatol. 2017; 153(1):101-3.
- Raduka J., Aggarwal A., Johnson K., Byun K., Trace A.P.. Bone scintigraphy findings in calciphylaxis. Radiol Case Rep. 2018; 13(2):315-9.
- Brandenburg V., Adragao T., Dam B., Evenepoel P., Frazao J.M., Ketteler M.. Blueprint for a European calciphylaxis registry initiative: the European Calciphylaxis Network (EuCalNet. Clin Kidney J. 2015; 8(5):567-71.
- B Gallo Marin, G Aghagoli, SL Hu, CM Massoud, L Robinson-Bostom. Calciphylaxis and Kidney Disease: A Review. Am J Kidney Dis. 2023; 81(2):232-9.
- Hayashi M., Takamatsu I., Kanno Y., Yoshida T., Abe T., Sato Y.. A case-control study of calciphylaxis in Japanese end-stage renal disease patients. Nephrol Dial Transplant. 2012; 27(4):1580-4.
- Nigwekar S.U., Bloch D.B., Nazarian R.M., Vermeer C., Booth S.L., Xu D.. Vitamin K-Dependent Carboxylation of Matrix Gla Protein Influences the Risk of Calciphylaxis. J Am Soc Nephrol. 2017; 28(6):1717-22.
- Toussaint N.D., Davies C.E., Bongetti E., Ruderman I., Elder G.J., Hawley C.M.. Calciphylaxis Episodes in the Australia and New Zealand Dialysis and Transplant Registry. Kidney Int Rep. 2024; 9(4):951-9.
- Fischer A.H., Morris D.J.. Pathogenesis of calciphylaxis: study of three cases with literature review. Hum Pathol. 1995; 26(10):1055-64.
- Rothe H., Brandenburg V., Haun M., Kollerits B., Kronenberg F., Ketteler M.. Ecto-5' -Nucleotidase CD73 (NT5E), vitamin D receptor and FGF23 gene polymorphisms may play a role in the development of calcific uremic arteriolopathy in dialysis patients - Data from the German Calciphylaxis Registry. PLoS One. 2017; 12(2)
- Girotto J.A., Harmon J.W., Ratner L.E., Nicol T.L., Wong L., Chen H.. Parathyroidectomy promotes wound healing and prolongs survival in patients with calciphylaxis from secondary hyperparathyroidism. Surgery. 2001; 130(4):50-1.
- Brandenburg V.M., Kramann R., Rothe H., Kaesler N., Korbiel J., Specht P.. Calcific uraemic arteriolopathy (calciphylaxis): data from a large nationwide registry. Nephrol Dial Transplant. 2017; 32(1):126-32.
- Mawad H.W., Sawaya B.P., Sarin R., Malluche H.H.. Calcific uremic arteriolopathy in association with low turnover uremic bone disease. Clin Nephrol. 1999; 52(3):160-6.
- Price P.A., Williamson M.K.. Primary structure of bovine matrix Gla protein, a new vitamin K-dependent bone protein. J Biol Chem. 1985; 260(28):14971-5.
- Luo G., Ducy P., McKee M.D., Pinero G.J., Loyer E., Behringer R.R.. Spontaneous calcification of arteries and cartilage in mice lacking matrix GLA protein. Nature. 1997; 386(6620):78-81.
- Mori K., Shioi A., Jono S., Nishizawa Y., Morii H.. Expression of matrix Gla protein (MGP) in an in vitro model of vascular calcification. FEBS Lett. 1998; 433(1-2):19-22.
- Proudfoot D., Shanahan C.M.. Molecular mechanisms mediating vascular calcification: role of matrix Gla protein. Nephrology (Carlton. 2006; 11(5):455-61.
- Wallin R., Wajih N., Greenwood G.T., Sane D.C.. Arterial calcification: a review of mechanisms, animal models, and the prospects for therapy. Med Res Rev. 2001; 21(4):274-301.
- Caluwe R., Verbeke F., Vriese A.S.. Evaluation of vitamin K status and rationale for vitamin K supplementation in dialysis patients. Nephrol Dial Transplant. 2020; 35(1):23-33.
- Schafer C., Heiss A., Schwarz A., Westenfeld R., Ketteler M., Floege J.. The serum protein alpha 2-Heremans-Schmid glycoprotein/fetuin-A is a systemically acting inhibitor of ectopic calcification. J Clin Invest. 2003; 112(3):357-66.
- Price P.A., Williamson M.K., Nguyen T.M., Than T.N.. Serum levels of the fetuin-mineral complex correlate with artery calcification in the rat. J Biol Chem. 2004; 279(3):1594-600.
- Westenfeld R., Schafer C., Smeets R., Brandenburg V.M., Floege J., Ketteler M.. Fetuin-A (AHSG) prevents extraosseous calcification induced by uraemia and phosphate challenge in mice. Nephrol Dial Transplant. 2007; 22(6):1537-46.
- Bajaj R., Courbebaisse M., Kroshinsky D., Thadhani R.I., Nigwekar S.U.. Calciphylaxis in Patients With Normal Renal Function: A Case Series and Systematic Review. Mayo Clin Proc. 2018; 93(9):1202-12.
- Yousuf S., Busch D., Renner R., Schliep S., Erfurt-Berge C.. Clinical characteristics and treatment modalities in uremic and non uremic calciphylaxis - a dermatological single-center experience. Ren Fail. 2024; 46(1)
- Hermans M.M., Brandenburg V., Ketteler M., Kooman J.P., Sande F.M., Boeschoten E.W.. Association of serum fetuin-A levels with mortality in dialysis patients. Kidney Int. 2007; 72(2):202-7.
- Hermans M.M., Brandenburg V., Ketteler M., Kooman J.P., Sande F.M., Gladziwa U.. Study on the relationship of serum fetuin-A concentration with aortic stiffness in patients on dialysis. Nephrol Dial Transplant. 2006; 21(5):1293-9.
- Ix J.H., Chertow G.M., Shlipak M.G., Brandenburg V.M., Ketteler M., Whooley M.A.. Fetuin-A and kidney function in persons with coronary artery disease--data from the Heart and Soul Study. Nephrol Dial Transplant. 2006; 21(8):2144-51.
- Marechal C., Schlieper G., Nguyen P., Kruger T., Coche E., Robert A.. Serum fetuin-A levels are associated with vascular calcifications and predict cardiovascular events in renal transplant recipients. Clin J Am Soc Nephrol. 2011; 6(5):974-85.
- Wolner Z., Tello L., Kalomeris T., Swerlick R., Magro C.M.. Redefining Calciphylaxis as a Uniquely Bone Forming Subcutaneous C5b-9-Mediated Microvascular Injury Syndrome Associated With Localized Subcutaneous and Systemic Complement Pathway Activation. Am J Dermatopathol. 2024; 46(12):807-18.
- Anderson M., Magro C., Belmont H.M.. Microvascular C5b-9 deposition in non-lesional skin in patients with SLE and its correlation with active lupus nephritis: a prospective observational study. Lupus Sci Med. 2023; 10(2)
- Magro C.M., Momtahen S., Mulvey J.J., Yassin A.H., Kaplan R.B., Laurence J.C.. Role of the skin biopsy in the diagnosis of atypical hemolytic uremic syndrome. Am J Dermatopathol. 2015; 37(5):57-9.
- Udomkarnjananun S., Kongnatthasate K., Praditpornsilpa K., Eiam-Ong S., Jaber B.L., Susantitaphong P.. Treatment of Calciphylaxis in CKD: A Systematic Review and Meta-analysis. Kidney Int Rep. 2019; 4(2):231-44.
- Wen W., Portales-Castillo I., Seethapathy R., Krinsky S., Kroshinsky D., Kalim S.. Intravenous sodium thiosulphate for vascular calcification of hemodialysis patients - a systematic review and meta-analysis. Nephrol Dial Transplant. 2022.
- Harris C., Kiaii M., Lau W., Farah M.. Multi-intervention management of calcific uremic arteriolopathy in 24 patients. Clin Kidney J. 2018; 11(5):704-9.
- McCarthy J.T., El-Azhary R.A., Patzelt M.T., Weaver A.L., Albright R.C., Bridges A.D.. Survival, Risk Factors, and Effect of Treatment in 101 Patients With Calciphylaxis. Mayo Clin Proc. 2016; 91(10):1384-94.
- Chinnadurai R., Sinha S., Lowney A.C., Miller M.. Pain management in patients with end-stage renal disease and calciphylaxis- a survey of clinical practices among physicians. BMC Nephrol. 2020; 21(1)
- Green J.A., Green C.R., Minott S.D.. Calciphylaxis treated with neurolytic lumbar sympathetic block: case report and review of the literature. Reg Anesth Pain Med. 2000; 25(3):310-2.
- Basile C., Montanaro A., Masi M., Pati G., Maio P., Gismondi A.. Hyperbaric oxygen therapy for calcific uremic arteriolopathy: a case series. J Nephrol. 2002; 15(6):676-80.
- F National Kidney. KDOQI Clinical Practice Guideline for Hemodialysis Adequacy: 2015 update. Am J Kidney Dis. 2015; 66(5):884-930.
- Adapa S., Naramala S., Gayam V., Koduri N.M., Daggubati Patel, P.. Calciphylaxis in a Patient on Home Hemodialysis. J Investig Med High Impact Case Rep. 2020; 8(2324709620922718)
- Baldwin C., Farah M., Leung M., Taylor P., Werb R., Kiaii M.. Multi-intervention management of calciphylaxis: a report of 7 cases. Am J Kidney Dis. 2011; 58(6):988-91.
- Ketteler M., Block G.A., Evenepoel P., Fukagawa M., Herzog C.A., McCann L.. Executive summary of the 2017 KDIGO Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD) Guideline Update: what's changed and why it matters. Kidney Int. 2017; 92(1):26-36.
- Nordheim E., Dahle D.O., Syse I.M., Asberg A., Reisaeter A.V., Hartmann A.. Resolution of Calciphylaxis After Urgent Kidney Transplantation in 3 Patients With End-Stage Kidney Failure. Transplant Direct. 2016; 2(11)
- Mohammed I.A., Sekar V., Bubtana A.J., Mitra S., Hutchison A.J.. Proximal calciphylaxis treated with calcimimetic 'Cinacalcet'. Nephrol Dial Transplant. 2008; 23(1):387-9.
- Sharma A., Burkitt-Wright E., Rustom R.. Cinacalcet as an adjunct in the successful treatment of calciphylaxis. Br J Dermatol. 2006; 155(6):1295-7.
- London G.M., Marchais S.J., Guerin A.P., Boutouyrie P., Metivier F., Vernejoul M.C.. Association of bone activity, calcium load, aortic stiffness, and calcifications in ESRD. J Am Soc Nephrol. 2008; 19(9):1827-35.
- Chertow G.M., Parfrey P.S.. Cinacalcet for cardiovascular disease in patients undergoing dialysis. N Engl J Med. 2013; 368(19):1844-5.
- Torregrosa J.V., Duran C.E., Barros X., Blasco M., Arias M., Cases A.. Successful treatment of calcific uraemic arteriolopathy with bisphosphonates. Nefrologia. 2012; 32(3):329-34.
- Torregrosa J.V., Sanchez-Escuredo A., Barros X., Blasco M., Campistol J.M.. Clinical management of calcific uremic arteriolopathy before and after therapeutic inclusion of bisphosphonates. Clin Nephrol. 2015; 83(4):231-4.
- Kodumudi V., Jeha G.M., Mydlo N., Kaye A.D.. Management of Cutaneous Calciphylaxis. Adv Ther. 2020; 37(12):4797-807.
- Tominaga A., Wada K., Kato Y., Okazaki K.. Course and treatment of severe osteoporosis complicated by calciphylaxis: a case report. JBMR Plus. 2025; 9(1)
- Hayden M.R., Goldsmith D., Sowers Khanna, R.. Calciphylaxis: calcific uremic arteriolopathy and the emerging role of sodium thiosulfate. Int Urol Nephrol. 2008; 40(2):443-51.
- Vedvyas C., Winterfield L.S., Vleugels R.A.. Calciphylaxis: a systematic review of existing and emerging therapies. J Am Acad Dermatol. 2012; 67(6)
- Nigwekar S.U., Brunelli S.M., Meade D., Wang W., Hymes J., Lacson E.. Sodium thiosulfate therapy for calcific uremic arteriolopathy. Clin J Am Soc Nephrol. 2013; 8(7):1162-70.
- Zitt E., Konig M., Vychytil A., Auinger M., Wallner M., Lingenhel G.. Use of sodium thiosulphate in a multi-interventional setting for the treatment of calciphylaxis in dialysis patients. Nephrol Dial Transplant. 2013; 28(5):1232-40.
- Lu Y., Shen L., Zhou L., Xu D.. Success of small-dose fractionated sodium thiosulfate in the treatment of calciphylaxis in a peritoneal dialysis patient. BMC Nephrol. 2022; 23(1)
- Gossett C., Suppadungsuk S., Krisanapan P., Tangpanithandee S., Thongprayoon C., Mao M.A.. Sodium Thiosulfate for Calciphylaxis Treatment in Patients on Peritoneal Dialysis: A Systematic Review. Medicina (Kaunas. 2023; 59(7)
- AlBugami M.M., Wilson J.A., Clarke Soroka, S.D.. Oral sodium thiosulfate as maintenance therapy for calcific uremic arteriolopathy: a case series. Am J Nephrol. 2013; 37(2):104-9.
- Strazzula L., Nigwekar S.U., Steele D., Tsiaras W., Sise M., Bis S.. Intralesional sodium thiosulfate for the treatment of calciphylaxis. JAMA Dermatol. 2013; 149(8):946-9.
- Wajih Z., Singer R.. Successful treatment of calciphylaxis with vitamin K in a patient on haemodialysis. Clin Kidney J. 2022; 15(2):354-6.
- Neofytou I.E., Stamou A., Demopoulos A., Roumeliotis S., Zebekakis P., Liakopoulos V.. Vitamin K for Vascular Calcification in Kidney Patients: Still Alive and Kicking, but Still a Lot to Learn. Nutrients. 2024; 16(12)
- Klingel R., Fassbender C., Fassbender T., Erdtracht B., Berrouschot J.. Rheopheresis: rheologic, functional, and structural aspects. Ther Apher. 2000; 4(5):348-57.
- Toksvang L.N., Berg R.M.. Using a classic paper by Robin Fahraeus and Torsten Lindqvist to teach basic hemorheology. Adv Physiol Educ. 2013; 37(2):129-33.
- Tsurumi-Ikeya Y., Tamura K., Azuma K., Mitsuhashi H., Wakui H., Nakazawa I.. Sustained inhibition of oxidized low-density lipoprotein is involved in the long-term therapeutic effects of apheresis in dialysis patients. Arterioscler Thromb Vasc Biol. 2010; 30(5):1058-65.
- Nakamura T., Ushiyama C., Osada S., Inoue T., Shimada N., Koide H.. Effect of low-density lipoprotein apheresis on plasma endothelin-1 levels in diabetic hemodialysis patients with arteriosclerosis obliterans. J Diabetes Complications. 2003; 17(6):349-54.
- Bouderlique E., Provot F., Lionet A.. Rheopheresis for Adjuvant Treatment in Resistant Calciphylaxis. Ther Apher Dial. 2018; 22(4):413-4.
- H Naciri Bennani, T Jouve, S Boudjemaa, H Gil, L Rostaing. Hemodialysis coupled with rheopheresis in calciphylaxis: A winning combination. J Clin Apher. 2019; 34(5):631-3.
- Robert T., Lionet A., Bataille S., Seret G.. Rheopheresis: A new therapeutic approach in severe calciphylaxis. Nephrology (Carlton. 2020; 25(4):298-304.
- Ferrer M.D., Ketteler M., Tur F., Tur E., Isern B., Salcedo C.. Characterization of SNF472 pharmacokinetics and efficacy in uremic and non-uremic rats models of cardiovascular calcification. PLoS One. 2018; 13(5)
- Perello J., Joubert P.H., Ferrer M.D., Canals A.Z., Sinha S., Salcedo C.. First-time-in-human randomized clinical trial in healthy volunteers and haemodialysis patients with SNF472, a novel inhibitor of vascular calcification. Br J Clin Pharmacol. 2018; 84(12):2867-76.
- Raggi P., Bellasi A., Sinha S., Bover J., Rodriguez M., Ketteler M.. Effects of SNF472, a Novel Inhibitor of Hydroxyapatite Crystallization in Patients Receiving Hemodialysis - Subgroup Analyses of the CALIPSO Trial. Kidney Int Rep. 2020; 5(12):2178-82.
- Sinha S., Nigwekar S.U., Brandenburg V., Gould L.J., Serena T.E., Moe S.M.. Hexasodium fytate for the treatment of calciphylaxis: a randomised, double-blind, phase 3, placebo-controlled trial with an open-label extension. EClinicalMedicine. 2024; 75(102784)
- Seethapathy H., Noureddine L.. Calciphylaxis: Approach to Diagnosis and Management. Adv Chronic Kidney Dis. 2019; 26(6):484-90.
- Fine A., Zacharias J.. Calciphylaxis is usually non-ulcerating: risk factors, outcome and therapy. Kidney Int. 2002; 61(6):2210-7.
- Sillero-Herrera A., Gomez-Herreros R., Engl Vergara-Lopez S.Calciphylaxis N.. J Med. 2018; 379(4):398-9.
- RAAK Arthur, MD Davis, MT McEvoy, LE Gibson, AL Weaver. Retrospective analysis of tissue plasminogen activator as an adjuvant treatment for calciphylaxis. JAMA Dermatol. 2013; 149(1):63-7.
- Darres A., Delaval R., Fournier A., Tournier E., Cointault O., Moussion F.. The Effectiveness of Topical Cerium Nitrate-Silver Sulfadiazine Application on Overall Outcome in Patients with Calciphylaxis. Dermatology. 2019; 235(2):120-9.
- JA Lopez Martinez, M Rodriguez Valiente, C Fuente-Mora, AM Garcia-Hernandez, S Canovas Sanchis, CJ Fernandez Pascual. Use of cryopreserved human amniotic membrane in the treatment of skin ulcers secondary to calciphylaxis. Dermatol Ther. 2021; 34(2)
- Cai M.M., Smith E.R., Brumby C., McMahon L.P., Holt S.G.. Fetuin-A-containing calciprotein particle levels can be reduced by dialysis, sodium thiosulphate and plasma exchange. Potential therapeutic implications for calciphylaxis? Nephrology (Carlton. 2013; 18(11):724-7.
- Siami G.A., Siami F.S.. Intensive tandem cryofiltration apheresis and hemodialysis to treat a patient with severe calciphylaxis, cryoglobulinemia, and end-stage renal disease. ASAIO J. 1999; 45(3):229-33.
- Tittelbach J., Graefe T., Wollina U.. Painful ulcers in calciphylaxis - combined treatment with maggot therapy and oral pentoxyfillin. J Dermatolog Treat. 2001; 12(4):211-4.
Références
1. Cucka B, Biglione B, Ko L, Nguyen ED, Khoury CC, Nigwekar SU, et al. Calciphylaxis arising following bariatric surgery: A case series. JAAD Case Rep. 2022;28:4-7.
2. Nigwekar SU, Kroshinsky D, Nazarian RM, Goverman J, Malhotra R, Jackson VA, et al. Calciphylaxis: risk factors, diagnosis, and treatment. Am J Kidney Dis. 2015;66(1):133-46.
3. Xia J, Tan AJ, Biglione B, Cucka B, Ko L, Nguyen ED, et al. Nephrogenic Calciphylaxis Arising after Bariatric Surgery: A Case Series. Am J Nephrol. 2024;55(2):196-201.
4. Nigwekar SU, Thadhani R, Brandenburg VM. Calciphylaxis. N Engl J Med. 2018;379(4):399-400.
5. Angelis M, Wong LL, Myers SA, Wong LM. Calciphylaxis in patients on hemodialysis: a prevalence study. Surgery. 1997;122(6):1083-9; discussion 9-90.
6. Gabel CK, Nguyen ED, Chakrala T, Blum AE, Francois J, Chand S, et al. Assessment of outcomes of calciphylaxis. J Am Acad Dermatol. 2021;85(4):1057-64.
7. Nigwekar SU, Zhao S, Wenger J, Hymes JL, Maddux FW, Thadhani RI, et al. A Nationally Representative Study of Calcific Uremic Arteriolopathy Risk Factors. J Am Soc Nephrol. 2016;27(11):3421-9.
8. Selye H, Gentile G, Prioreschi P. Cutaneous molt induced by calciphylaxis in the rat. Science. 1961;134(3493):1876-7.
9. Ghosh T, Winchester DS, Davis MDP, El-Azhary R, Comfere NI. Early clinical presentations and progression of calciphylaxis. Int J Dermatol. 2017;56(8):856-61.
10. Naranjo A, Rayess N, Ryan E, Iv M, Mahajan VB. Retinal artery and vein occlusion in calciphylaxis. Am J Ophthalmol Case Rep. 2022;26:101433.
11. Ellis CL, O'Neill WC. Questionable specificity of histologic findings in calcific uremic arteriolopathy. Kidney Int. 2018;94(2):390-5.
12. Jeong HS, Dominguez AR. Calciphylaxis: Controversies in Pathogenesis, Diagnosis and Treatment. Am J Med Sci. 2016;351(2):217-27.
13. Rivet J, Lebbe C, Urena P, Cordoliani F, Martinez F, Baglin AC, et al. Cutaneous calcification in patients with end-stage renal disease: a regulated process associated with in situ osteopontin expression. Arch Dermatol. 2006;142(7):900-6.
14. Dobry AS, Nguyen ED, Shah R, Mihm MC, Kroshinsky D. The role of skin biopsy in diagnosis and management of calciphylaxis: A retrospective analysis. J Am Acad Dermatol. 2021;85(3):765-7.
15. Williams EA, Moy AP, Cipriani NA, Nigwekar SU, Nazarian RM. Factors associated with false-negative pathologic diagnosis of calciphylaxis. J Cutan Pathol. 2019;46(1):16-25.
16. Mochel MC, Arakaki RY, Wang G, Kroshinsky D, Hoang MP. Cutaneous calciphylaxis: a retrospective histopathologic evaluation. Am J Dermatopathol. 2013;35(5):582-6.
17. Groover M, Nutan F. Role of bone scan in diagnosis of calciphylaxis: A review. JAAD Int. 2024;14:31-3.
18. Gupta K, Suthar PP, Bhave N, Singh JS, Venkatraman SMK, Jadhav RB. Potential Role of Bone Scintigraphy in the Diagnosis of Calciphylaxis. World J Nucl Med. 2024;23(1):3-9.
19. Paul S, Rabito CA, Vedak P, Nigwekar SU, Kroshinsky D. The Role of Bone Scintigraphy in the Diagnosis of Calciphylaxis. JAMA Dermatol. 2017;153(1):101-3.
20. Raduka J, Aggarwal A, Johnson K, Byun K, Trace AP. Bone scintigraphy findings in calciphylaxis. Radiol Case Rep. 2018;13(2):315-9.
21. Brandenburg V, Adragao T, van Dam B, Evenepoel P, Frazao JM, Ketteler M, et al. Blueprint for a European calciphylaxis registry initiative: the European Calciphylaxis Network (EuCalNet). Clin Kidney J. 2015;8(5):567-71.
22. Gallo Marin B, Aghagoli G, Hu SL, Massoud CM, Robinson-Bostom L. Calciphylaxis and Kidney Disease: A Review. Am J Kidney Dis. 2023;81(2):232-9.
23. Hayashi M, Takamatsu I, Kanno Y, Yoshida T, Abe T, Sato Y, et al. A case-control study of calciphylaxis in Japanese end-stage renal disease patients. Nephrol Dial Transplant. 2012;27(4):1580-4.
24. Nigwekar SU, Bloch DB, Nazarian RM, Vermeer C, Booth SL, Xu D, et al. Vitamin K-Dependent Carboxylation of Matrix Gla Protein Influences the Risk of Calciphylaxis. J Am Soc Nephrol. 2017;28(6):1717-22.
25. Toussaint ND, Davies CE, Bongetti E, Ruderman I, Elder GJ, Hawley CM, et al. Calciphylaxis Episodes in the Australia and New Zealand Dialysis and Transplant Registry. Kidney Int Rep. 2024;9(4):951-9.
26. Fischer AH, Morris DJ. Pathogenesis of calciphylaxis: study of three cases with literature review. Hum Pathol. 1995;26(10):1055-64.
27. Rothe H, Brandenburg V, Haun M, Kollerits B, Kronenberg F, Ketteler M, et al. Ecto-5' -Nucleotidase CD73 (NT5E), vitamin D receptor and FGF23 gene polymorphisms may play a role in the development of calcific uremic arteriolopathy in dialysis patients - Data from the German Calciphylaxis Registry. PLoS One. 2017;12(2):e0172407.
28. Girotto JA, Harmon JW, Ratner LE, Nicol TL, Wong L, Chen H. Parathyroidectomy promotes wound healing and prolongs survival in patients with calciphylaxis from secondary hyperparathyroidism. Surgery. 2001;130(4):645-50; discussion 50-1.
29. Brandenburg VM, Kramann R, Rothe H, Kaesler N, Korbiel J, Specht P, et al. Calcific uraemic arteriolopathy (calciphylaxis): data from a large nationwide registry. Nephrol Dial Transplant. 2017;32(1):126-32.
30. Mawad HW, Sawaya BP, Sarin R, Malluche HH. Calcific uremic arteriolopathy in association with low turnover uremic bone disease. Clin Nephrol. 1999;52(3):160-6.
31. Price PA, Williamson MK. Primary structure of bovine matrix Gla protein, a new vitamin K-dependent bone protein. J Biol Chem. 1985;260(28):14971-5.
32. Luo G, Ducy P, McKee MD, Pinero GJ, Loyer E, Behringer RR, et al. Spontaneous calcification of arteries and cartilage in mice lacking matrix GLA protein. Nature. 1997;386(6620):78-81.
33. Mori K, Shioi A, Jono S, Nishizawa Y, Morii H. Expression of matrix Gla protein (MGP) in an in vitro model of vascular calcification. FEBS Lett. 1998;433(1-2):19-22.
34. Proudfoot D, Shanahan CM. Molecular mechanisms mediating vascular calcification: role of matrix Gla protein. Nephrology (Carlton). 2006;11(5):455-61.
35. Wallin R, Wajih N, Greenwood GT, Sane DC. Arterial calcification: a review of mechanisms, animal models, and the prospects for therapy. Med Res Rev. 2001;21(4):274-301.
36. Caluwe R, Verbeke F, De Vriese AS. Evaluation of vitamin K status and rationale for vitamin K supplementation in dialysis patients. Nephrol Dial Transplant. 2020;35(1):23-33.
37. Schafer C, Heiss A, Schwarz A, Westenfeld R, Ketteler M, Floege J, et al. The serum protein alpha 2-Heremans-Schmid glycoprotein/fetuin-A is a systemically acting inhibitor of ectopic calcification. J Clin Invest. 2003;112(3):357-66.
38. Price PA, Williamson MK, Nguyen TM, Than TN. Serum levels of the fetuin-mineral complex correlate with artery calcification in the rat. J Biol Chem. 2004;279(3):1594-600.
39. Westenfeld R, Schafer C, Smeets R, Brandenburg VM, Floege J, Ketteler M, et al. Fetuin-A (AHSG) prevents extraosseous calcification induced by uraemia and phosphate challenge in mice. Nephrol Dial Transplant. 2007;22(6):1537-46.
40. Bajaj R, Courbebaisse M, Kroshinsky D, Thadhani RI, Nigwekar SU. Calciphylaxis in Patients With Normal Renal Function: A Case Series and Systematic Review. Mayo Clin Proc. 2018;93(9):1202-12.
41. Yousuf S, Busch D, Renner R, Schliep S, Erfurt-Berge C. Clinical characteristics and treatment modalities in uremic and non uremic calciphylaxis - a dermatological single-center experience. Ren Fail. 2024;46(1):2297566.
42. Hermans MM, Brandenburg V, Ketteler M, Kooman JP, van der Sande FM, Boeschoten EW, et al. Association of serum fetuin-A levels with mortality in dialysis patients. Kidney Int. 2007;72(2):202-7.
43. Hermans MM, Brandenburg V, Ketteler M, Kooman JP, van der Sande FM, Gladziwa U, et al. Study on the relationship of serum fetuin-A concentration with aortic stiffness in patients on dialysis. Nephrol Dial Transplant. 2006;21(5):1293-9.
44. Ix JH, Chertow GM, Shlipak MG, Brandenburg VM, Ketteler M, Whooley MA. Fetuin-A and kidney function in persons with coronary artery disease--data from the Heart and Soul Study. Nephrol Dial Transplant. 2006;21(8):2144-51.
45. Marechal C, Schlieper G, Nguyen P, Kruger T, Coche E, Robert A, et al. Serum fetuin-A levels are associated with vascular calcifications and predict cardiovascular events in renal transplant recipients. Clin J Am Soc Nephrol. 2011;6(5):974-85.
46. Wolner Z, Tello L, Kalomeris T, Swerlick R, Magro CM. Redefining Calciphylaxis as a Uniquely Bone Forming Subcutaneous C5b-9-Mediated Microvascular Injury Syndrome Associated With Localized Subcutaneous and Systemic Complement Pathway Activation. Am J Dermatopathol. 2024;46(12):807-18.
47. Anderson M, Magro C, Belmont HM. Microvascular C5b-9 deposition in non-lesional skin in patients with SLE and its correlation with active lupus nephritis: a prospective observational study. Lupus Sci Med. 2023;10(2).
48. Magro CM, Momtahen S, Mulvey JJ, Yassin AH, Kaplan RB, Laurence JC. Role of the skin biopsy in the diagnosis of atypical hemolytic uremic syndrome. Am J Dermatopathol. 2015;37(5):349-56; quiz 57-9.
49. Udomkarnjananun S, Kongnatthasate K, Praditpornsilpa K, Eiam-Ong S, Jaber BL, Susantitaphong P. Treatment of Calciphylaxis in CKD: A Systematic Review and Meta-analysis. Kidney Int Rep. 2019;4(2):231-44.
50. Wen W, Portales-Castillo I, Seethapathy R, Krinsky S, Kroshinsky D, Kalim S, et al. Intravenous sodium thiosulphate for vascular calcification of hemodialysis patients - a systematic review and meta-analysis. Nephrol Dial Transplant. 2022.
51. Harris C, Kiaii M, Lau W, Farah M. Multi-intervention management of calcific uremic arteriolopathy in 24 patients. Clin Kidney J. 2018;11(5):704-9.
52. McCarthy JT, El-Azhary RA, Patzelt MT, Weaver AL, Albright RC, Bridges AD, et al. Survival, Risk Factors, and Effect of Treatment in 101 Patients With Calciphylaxis. Mayo Clin Proc. 2016;91(10):1384-94.
53. Chinnadurai R, Sinha S, Lowney AC, Miller M. Pain management in patients with end-stage renal disease and calciphylaxis- a survey of clinical practices among physicians. BMC Nephrol. 2020;21(1):403.
54. Green JA, Green CR, Minott SD. Calciphylaxis treated with neurolytic lumbar sympathetic block: case report and review of the literature. Reg Anesth Pain Med. 2000;25(3):310-2.
55. Basile C, Montanaro A, Masi M, Pati G, De Maio P, Gismondi A. Hyperbaric oxygen therapy for calcific uremic arteriolopathy: a case series. J Nephrol. 2002;15(6):676-80.
56. National Kidney F. KDOQI Clinical Practice Guideline for Hemodialysis Adequacy: 2015 update. Am J Kidney Dis. 2015;66(5):884-930.
57. Adapa S, Naramala S, Gayam V, Koduri NM, Daggubati SR, Patel P, et al. Calciphylaxis in a Patient on Home Hemodialysis. J Investig Med High Impact Case Rep. 2020;8:2324709620922718.
58. Baldwin C, Farah M, Leung M, Taylor P, Werb R, Kiaii M, et al. Multi-intervention management of calciphylaxis: a report of 7 cases. Am J Kidney Dis. 2011;58(6):988-91.
59. Ketteler M, Block GA, Evenepoel P, Fukagawa M, Herzog CA, McCann L, et al. Executive summary of the 2017 KDIGO Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD) Guideline Update: what's changed and why it matters. Kidney Int. 2017;92(1):26-36.
60. Nordheim E, Dahle DO, Syse IM, Asberg A, Reisaeter AV, Hartmann A. Resolution of Calciphylaxis After Urgent Kidney Transplantation in 3 Patients With End-Stage Kidney Failure. Transplant Direct. 2016;2(11):e113.
61. Mohammed IA, Sekar V, Bubtana AJ, Mitra S, Hutchison AJ. Proximal calciphylaxis treated with calcimimetic 'Cinacalcet'. Nephrol Dial Transplant. 2008;23(1):387-9.
62. Sharma A, Burkitt-Wright E, Rustom R. Cinacalcet as an adjunct in the successful treatment of calciphylaxis. Br J Dermatol. 2006;155(6):1295-7.
63. London GM, Marchais SJ, Guerin AP, Boutouyrie P, Metivier F, de Vernejoul MC. Association of bone activity, calcium load, aortic stiffness, and calcifications in ESRD. J Am Soc Nephrol. 2008;19(9):1827-35.
64. Chertow GM, Parfrey PS. Cinacalcet for cardiovascular disease in patients undergoing dialysis. N Engl J Med. 2013;368(19):1844-5.
65. Torregrosa JV, Duran CE, Barros X, Blasco M, Arias M, Cases A, et al. Successful treatment of calcific uraemic arteriolopathy with bisphosphonates. Nefrologia. 2012;32(3):329-34.
66. Torregrosa JV, Sanchez-Escuredo A, Barros X, Blasco M, Campistol JM. Clinical management of calcific uremic arteriolopathy before and after therapeutic inclusion of bisphosphonates. Clin Nephrol. 2015;83(4):231-4.
67. Kodumudi V, Jeha GM, Mydlo N, Kaye AD. Management of Cutaneous Calciphylaxis. Adv Ther. 2020;37(12):4797-807.
68. Tominaga A, Wada K, Kato Y, Okazaki K. Course and treatment of severe osteoporosis complicated by calciphylaxis: a case report. JBMR Plus. 2025;9(1):ziae154.
69. Hayden MR, Goldsmith D, Sowers JR, Khanna R. Calciphylaxis: calcific uremic arteriolopathy and the emerging role of sodium thiosulfate. Int Urol Nephrol. 2008;40(2):443-51.
70. Vedvyas C, Winterfield LS, Vleugels RA. Calciphylaxis: a systematic review of existing and emerging therapies. J Am Acad Dermatol. 2012;67(6):e253-60.
71. Nigwekar SU, Brunelli SM, Meade D, Wang W, Hymes J, Lacson E, Jr. Sodium thiosulfate therapy for calcific uremic arteriolopathy. Clin J Am Soc Nephrol. 2013;8(7):1162-70.
72. Zitt E, Konig M, Vychytil A, Auinger M, Wallner M, Lingenhel G, et al. Use of sodium thiosulphate in a multi-interventional setting for the treatment of calciphylaxis in dialysis patients. Nephrol Dial Transplant. 2013;28(5):1232-40.
73. Lu Y, Shen L, Zhou L, Xu D. Success of small-dose fractionated sodium thiosulfate in the treatment of calciphylaxis in a peritoneal dialysis patient. BMC Nephrol. 2022;23(1):4.
74. Gossett C, Suppadungsuk S, Krisanapan P, Tangpanithandee S, Thongprayoon C, Mao MA, et al. Sodium Thiosulfate for Calciphylaxis Treatment in Patients on Peritoneal Dialysis: A Systematic Review. Medicina (Kaunas). 2023;59(7).
75. AlBugami MM, Wilson JA, Clarke JR, Soroka SD. Oral sodium thiosulfate as maintenance therapy for calcific uremic arteriolopathy: a case series. Am J Nephrol. 2013;37(2):104-9.
76. Strazzula L, Nigwekar SU, Steele D, Tsiaras W, Sise M, Bis S, et al. Intralesional sodium thiosulfate for the treatment of calciphylaxis. JAMA Dermatol. 2013;149(8):946-9.
77. Wajih Z, Singer R. Successful treatment of calciphylaxis with vitamin K in a patient on haemodialysis. Clin Kidney J. 2022;15(2):354-6.
78. Neofytou IE, Stamou A, Demopoulos A, Roumeliotis S, Zebekakis P, Liakopoulos V, et al. Vitamin K for Vascular Calcification in Kidney Patients: Still Alive and Kicking, but Still a Lot to Learn. Nutrients. 2024;16(12).
79. Klingel R, Fassbender C, Fassbender T, Erdtracht B, Berrouschot J. Rheopheresis: rheologic, functional, and structural aspects. Ther Apher. 2000;4(5):348-57.
80. Toksvang LN, Berg RM. Using a classic paper by Robin Fahraeus and Torsten Lindqvist to teach basic hemorheology. Adv Physiol Educ. 2013;37(2):129-33.
81. Tsurumi-Ikeya Y, Tamura K, Azuma K, Mitsuhashi H, Wakui H, Nakazawa I, et al. Sustained inhibition of oxidized low-density lipoprotein is involved in the long-term therapeutic effects of apheresis in dialysis patients. Arterioscler Thromb Vasc Biol. 2010;30(5):1058-65.
82. Nakamura T, Ushiyama C, Osada S, Inoue T, Shimada N, Koide H. Effect of low-density lipoprotein apheresis on plasma endothelin-1 levels in diabetic hemodialysis patients with arteriosclerosis obliterans. J Diabetes Complications. 2003;17(6):349-54.
83. Bouderlique E, Provot F, Lionet A. Rheopheresis for Adjuvant Treatment in Resistant Calciphylaxis. Ther Apher Dial. 2018;22(4):413-4.
84. Naciri Bennani H, Jouve T, Boudjemaa S, Gil H, Rostaing L. Hemodialysis coupled with rheopheresis in calciphylaxis: A winning combination. J Clin Apher. 2019;34(5):631-3.
85. Robert T, Lionet A, Bataille S, Seret G. Rheopheresis: A new therapeutic approach in severe calciphylaxis. Nephrology (Carlton). 2020;25(4):298-304.
86. Ferrer MD, Ketteler M, Tur F, Tur E, Isern B, Salcedo C, et al. Characterization of SNF472 pharmacokinetics and efficacy in uremic and non-uremic rats models of cardiovascular calcification. PLoS One. 2018;13(5):e0197061.
87. Perello J, Joubert PH, Ferrer MD, Canals AZ, Sinha S, Salcedo C. First-time-in-human randomized clinical trial in healthy volunteers and haemodialysis patients with SNF472, a novel inhibitor of vascular calcification. Br J Clin Pharmacol. 2018;84(12):2867-76.
88. Raggi P, Bellasi A, Sinha S, Bover J, Rodriguez M, Ketteler M, et al. Effects of SNF472, a Novel Inhibitor of Hydroxyapatite Crystallization in Patients Receiving Hemodialysis - Subgroup Analyses of the CALIPSO Trial. Kidney Int Rep. 2020;5(12):2178-82.
89. Sinha S, Nigwekar SU, Brandenburg V, Gould LJ, Serena TE, Moe SM, et al. Hexasodium fytate for the treatment of calciphylaxis: a randomised, double-blind, phase 3, placebo-controlled trial with an open-label extension. EClinicalMedicine. 2024;75:102784.
90. Seethapathy H, Noureddine L. Calciphylaxis: Approach to Diagnosis and Management. Adv Chronic Kidney Dis. 2019;26(6):484-90.
91. Fine A, Zacharias J. Calciphylaxis is usually non-ulcerating: risk factors, outcome and therapy. Kidney Int. 2002;61(6):2210-7.
92. Sillero-Herrera A, Gomez-Herreros R, Vergara-Lopez S. Calciphylaxis. N Engl J Med. 2018;379(4):398-9.
93. el-Azhary RA, Arthur AK, Davis MD, McEvoy MT, Gibson LE, Weaver AL, et al. Retrospective analysis of tissue plasminogen activator as an adjuvant treatment for calciphylaxis. JAMA Dermatol. 2013;149(1):63-7.
94. Darres A, Delaval R, Fournier A, Tournier E, Cointault O, Moussion F, et al. The Effectiveness of Topical Cerium Nitrate-Silver Sulfadiazine Application on Overall Outcome in Patients with Calciphylaxis. Dermatology. 2019;235(2):120-9.
95. Lopez Martinez JA, Rodriguez Valiente M, Fuente-Mora C, Garcia-Hernandez AM, Canovas Sanchis S, Fernandez Pascual CJ. Use of cryopreserved human amniotic membrane in the treatment of skin ulcers secondary to calciphylaxis. Dermatol Ther. 2021;34(2):e14769.
96. Cai MM, Smith ER, Brumby C, McMahon LP, Holt SG. Fetuin-A-containing calciprotein particle levels can be reduced by dialysis, sodium thiosulphate and plasma exchange. Potential therapeutic implications for calciphylaxis? Nephrology (Carlton). 2013;18(11):724-7.
97. Siami GA, Siami FS. Intensive tandem cryofiltration apheresis and hemodialysis to treat a patient with severe calciphylaxis, cryoglobulinemia, and end-stage renal disease. ASAIO J. 1999;45(3):229-33.
98. Tittelbach J, Graefe T, Wollina U. Painful ulcers in calciphylaxis - combined treatment with maggot therapy and oral pentoxyfillin. J Dermatolog Treat. 2001;12(4):211-4.
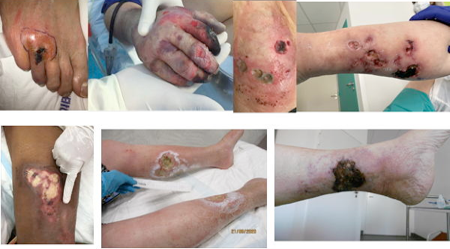
Téléchargements
Soumis
Accepté
Publié
Comment citer
Numéro
Rubrique
Licence
© Pablo Antonio Ureña Torres 2025

Ce travail est disponible sous la licence Creative Commons Attribution 4.0 International .










